برای انتقال حرارت از داخل یك محفظه یا اتاق به خارج , احتیاج به یك واسطه است. در یك سیستم سرد كننده مكانیكی استاندارد , عمل گرفتن حرارت با تبخیر مایعی در دستگاه تبخیر (Evaporator), و پس دادن آن در دستگاه تقطیر (Condenser) صورت می گیرد و این امر باعث تغییر حالت ماده سرمازا از بخار به مایع می گردد .مایعاتی كه بتوانند به سهولت از مایع به بخار و بالعكس تبدیل شوند به عنوان واسطه انتقال حرارت به كار برده می شوند, زیرا این تغییر حالت باعث تغییر حرارت نیز می گردد .برخی از این مواد سرمازا از مواد دیگر مناسب تر هستند .
خصوصیات مواد سرمازا :
سیالی كه به عنوان ماده سرمازا مورد استفاده قرار می گیرد باید دارای كیفیات زیر باشد:
1- سمی نباشد.
2- قابل انفجار نباشد .
3-اكسید كننده نباشد .
4- قابل اشتعال نباشد .
5- در صورت نشت به سهولت قابل تشخیص باشد
6- محل نشت آن قابل تعیین باشد .
7- قادر به عمل كردن در فشار كم باشد (نقطه جوش پایین) .
8- از نوع گازهای پایدار باشد .
9- قسمت هایی كه در داخل مایع حركت می كند به سهولت قابل روغنكاری باشند.
10- تنفس كردن آن مضر نباشد .
11- دارای گرمای نهان متعادلی برای مقدار تبخیر در واحد زمان باشد .
12- جابجایی نسبی آن برای ایجاد مقدار معینی برودت كم باشد .
13- دارای كمترین اختلاف, بین فشار تبخیر و تقطیر باشد .
ماده سرمازا نباید خورنده باشد (ایجاد زنگ زدگی كند) تا ساختن تمام قطعات سیستم از فلزات معمولی با عمر خدمتی طولانی تر عملی گردد.
مبنای مقایسه مواد سرمازای به كار رفته در صنعت سرد كنندگی , بر اساس حرارت تبخیر 5 درجه فارنهایت و حرارت تقطیر 68 درجه فارنهایت است .
شناسایی مواد سرمازا بوسیله شماره گذاری :
روش جدید مشخص كردن مواد سرما زا در صنایع تبرید , شماره گذاری این مواد است . پیش حرف R كه مخفف كلمه REFRIGERANT به معنای سرمازا است نوشته می شود. روش مشخص نمودن شماره ای توسط انجمن مهندسین تهویه ,تبرید و حرارت مركزی آمریكا متداول شده است .
طبقه بندی مواد سرما زا :
این مواد بوسیله دو سازمان ملی آمریكایی به نام های :
The national refrigeration safety code
The national board of fire underwriters طبقه بندی شده اند.
سازمان اول تمام مایعات سرمازا به سه گروه زیر تقسیم بندی می كند:
گروه اول – بی خطر ترین مواد كه شامل R-500,R-14,R-13,R-502,R-744 R-13BL,R-22,R-30,R-12,R-114,R-21,R-11,R-113 می باشد.
گروه دوم _ مواد سمی و تا حدی قابل اشتعال كه شاملR-717,R-40,R-764, R-1130,R-160,R-611 می باشد.
گروه سوم _ مواد قابل اشتعال كه شامل R-50,R-1150,R-170,R-290-
می باشد.
موسسه NBFU نیز مواد سرمازا را نسبت به درجه سمی بودن آن ها طبقه بندی كرده است كه شامل شش گروه است كه بی خطر ترین آن ها گروه یك است.
GROUP 1 CLASS
R-744 Carbon Dioxide 5
R-12 6
R-13B1 Kulene-131 6
R-21 6
R-114 6
R-30 Carrene No. 1 4
R-11 6
R-22 5
R-113 4
R-500 6
R-502 6
R-503 6
R-504 6
R-40 Methylene Chloride 4
GROUP 2
R-717 Ammonia 2
R-1130 Dichloroethylene 4
R-160 Ethyl Chloride 4
R-40 Methyl Chloride 4
R-611 Methyl Formate 3
R-764 Sulphur Dioxide 1
GROUP 3
R-600 Butane 5
R-170 Ethane 5
R-601 Iso Butane 5
R-290 Propane 5
در اینجا به بررسی بعضی از مبردهای متداول می پردازیم
22-R (دی كلرودی فلورو متان ) (CCl2F2) :
ماده ای است بیرنگ تقریبا بی بو و در فشار اتمسفر دارای نقطه جوشی معادل 7/21 درجه فارنهایت است . ماده ای غیر سمی و غیر قابل اشتعال است و خورنده نیست , از نظر شیمیایی در حرارت های عملیاتی بی اثر است و از نظر حرارتی تا 1022 درجه پایدار باقی می ماند .
12- R :
دارای گرمای نهان نسبتا پایین است و برای مصرف در دستگاه های كوچك تر مناسب می باشد , زیرا گردش مقدار زیادی ماده سرما زا امكان استفاده از مكانیزم های عملیاتی و تنظیم دقیق تر و در عین حال با حساسیت كمتر را میسر می كند . از این مبرد در كمپرسور های پیستونی و دورانی و انواع بزرگ گریز از مركزی استفاده می شود .
این ماده در فشار های سر , و معكوس (پس فشار) كم , ولی مثبت با یك بازدهی حجمی خوب كار می كند , 12- R , در 5 درجه فارنهایت , فشاری معادل 5/26 پوند بر اینچ مربع مطلق , و در 86 درجه فارنهایت دارای فشاری مطلق معادل 8/108 پوند بر اینچ مربع است .
گرمای نهان آن در 5 درجه فارنهایت 2/68 بی-تی- یو است و نشت آن به سهولت و با استفاده از نشت یاب الكترونیكی یا مشعل هالاید مشخص می گردد.
در حرارت صفر درجه مقدار كمی آب در 12-R حل می شود كه نسبت آن بر حسب وزن 6 در ملیون است . مایعی كه تولید می شود تا حدودی بر روی اكثر فلزات معمولی كه در ساختمان دستگاه های سرد كننده استفاده می شود , ایجاد زنگ می كند . اضافه كردن روغن های معدنی هیچگونه اثری در ایجاد رنگ بوسیله مایع ندارد ولی احتمالا كم رنگ شدن مایع به وسیله آب را كاهش می دهد . حساسیت ماده 12-R نسبت به آب در مقایسه با 22-R و 502-R بیشتر است . تا 90 درجه قابل حل شدن در روغن است . در این حرارت روغن شروع به جدا شدن می كند و به علت سبك تر بودن وزن در سطح آن جمع می شود .
به كار بردن 30 پوند از این ماده به ازای هر 1000 فوت مكعب فضای تهویه شده كاملا بی خطر است .
این ماده در سیلندر های به اندازه مختلف عرضه می شود و احتمالا در قوطی های سر بسته و محكم نیز یافت می شود . كد رنگی مخصوص 12- R سفید است .
22-R منوكلرودی فلورو متان (CHCLF2) :
22-R یك ماده سرمازای مصنوعی است كه انحصارا برای دستگاه های تبریدی كه درجه تبخیر پایینی دارند ساخته شده است . یكی از موارد استفاده آن در دستگاه های انجماد سریع است كه حرارت آن ها بین 20 تا 40 درجه فارنهایت حفظ می گردد . همچنین در دستگاه های تهویه مطبوع و یخچال های خانگی نیز به طور موفقیت آمیزی مورد استفاده قرار گرفته است . 22-R فقط در كمپرسورهای پیستونی به كار گرفته می شوند و فشار عملیاتی آن به نحوی است كه برای نیل به درجات پایین , نیازی به كار كردن در فشار های كمتر از جو نیست . گرمای نهان آن به ازای هر پوند در 5 درجه فارنهایت 21/93 بی-تی-یو است . فشار عادی سر كمپرسور در 86 درجه 82/172 پوند بر اینچ مربع مطلق است .
22-R ماده ای پایدار ,غیر سمی ,بدون اثر اكسید كنندگی , بی آزار و غیر قابل اشتعال است . فشار اواپراتور در 5 درجه فارنهایت 43 پوند بر اینچ مربع است . حلالیت آن در آب 3 برابر 12-R است . بنابراین رطوبت در این ماده باید حداقل باشد .به همین دلیل استفاده از رطوبت گیر و خشك كن در این مورد بیشتر است .
به علت تمایل شدید تر 22-R به آب تعداد بیشتری رطوبت گیر برای خشك كردن آن لازم است. 22-R تا حرارت16درجه فارنهایت در روغن حل می شود وپس از ان روغن شروع به جدا شدن نموده و چون از مایع سبك تر است در سطح آن جمع می شود. وجود نشت را می توان به وسیله ی نشت یاب الكترونیكی و یا مشعل هالاید تیین كرد.
مواد سرما زای مخلوط :
همانطور كه از نامشان پیداست , این مواد مخلوطی از دو یا چند ماده ی سرما زا هستند, ولی مانند یك ماده سرما زای واحد عمل می كنند. و چهار نوع متداولتر آنها عبارتند از:
1)R-500 كه مخلوطی است از 8/73 درصد R-12 و 2/26 درصد R-152a
2)R-502 كه مخلوطی است از8/ 48 درصد R-22 و 2/ 51درصد R-115
3) كه مخلوطی است از 1/ 41 درصد R-23 و 9/ 59 درصد R-13
4) كه مخلوطی است از 2/ 48 درصد R-32 و 8/ 51 درصد R-115
این مواد سرما زا موادی ثبت شده هستند كه مراحل تركیب آنها پیچیده است و متصدی سرویس نباید با اختلاط مواد مبرد اقدام به ساختن ماده ای مخصوص بنماید.







 پاسخ با نقل قول
پاسخ با نقل قول


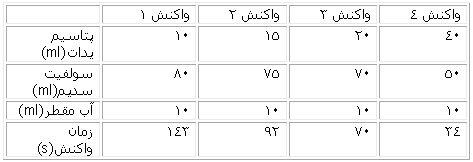
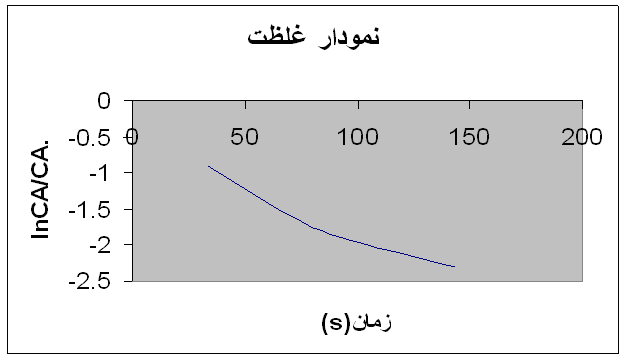



علاقه مندی ها (بوک مارک ها)