منیزیم
منیزیم ، عنصر شیمیایی است که در جدول تناوبی دارای نشان Mg و عدد اتمی 12 میباشد. منیزیم ، هشتمین عنصر فراوان است و تقریبا" 2% پوسته زمین را تشکیل میدهد و سومین عنصر فراوان محلول در آب دریا به حساب میآید. کاربرد اصلی این فلز قلیایی خاکی ، بعنوان عامل آلیاژ ساز برای ساخت آلیاژ آلومینیم – منیزیم میباشد.
خصوصیات قابل توجه
منیزیم ، فلزی سبک ، سفید رنگ و نسبتا" محکم است ( یکسوم از آلومینیوم سبکتر ) که در معرض هوا بهآرامی کدر میگردد. پودر این فلز ، هنگامیکه در معرض هوا قرار گیرد، گرم شده ، با شعلههای سفید رنگی میسوزد. اگرچه به شکل نوارهای باریک بهآسانی محترق میشود، سوختن مقادیر زیاد آن دشوار است.
کاربردهــــــا
ترکیبات منیزیم ، بخصوص اکسید منیزیم ، بیشتر بعنوان مواد دیرگداز در کورههای تولید آهن و فولاد ، فلزات غیرآهن ، شیشه و سیمان ، مورد استفاده قرار میگیرد. اکسید منیزیم و سایر ترکیبات هم در صنایع عمرانی ، شیمیایی و کشاورزی بکار میروند. عمده کاربرد منیزیم بصورت یک افزودنی آلیاژساز به آلومینیوم است که از این آلیاژ ، بیشتر در قوطیهای مواد آشامیدنی استفاده میگردد.
همچنین آلیاژهای منیزیم ، اجزای ساختاری اتومبیلها و ماشینآلات را تشکیل میدهند. کاربرد دیگر این فلز ، کمک به جداسازی گوگرد از آهن و فولاد است.
سایر کاربردها
منیزیم ، مانند آلومینیم ، محکم و سبک است، بنابراین اغلب در چرخهای مرغوب که mag wheels نامیده میشوند، بکار میرود.
آلیاژ این فلز در ساخت هواپیما و موشک ضروری است.
منیزیم در صورتیکه بعنوان عامل آلیاژ ساز بکار رود، خصوصیات تولیدی ، مکانیکی و جوش خوردن آلومینیم را ارتقا میدهد.
عامل افزودنی برای پیشرانهای معمولی و مورد استفاده در تولید گلولههای کوچک گرافیت در چدن.
عامل کاهنده برای ساخت اورانیوم خالص و فلزات دیگر از نمکهایشان.
هیدروکسید آن در شیر منیزی ، کلرید و سولفات آن در سولفات دومنیزی و سیتراتهای آن در پزشکی کاربرد دارند.
مگنزیت Dead-burned برای مقاصد دیر گداز از قبیل آجر و آسترهای محافظ در کورهها مورد استفاده است.
منیزیم همچنین در دمای 4000 درجه فارینهایت قابل اشتعال و احتراق است.
دمای فوقالعاده زیادی که برای سوزاندن منیزیم نیاز است، این عنصر را تبدیل به ابزاری راحت برای شروع آتشهای ناگهانی هنگام تفریحات سالم در فضای باز میکند.
پودر کربنات منیزیم ( MgCO3) توسط ورزشکاران رشتههایی چون ژیمناستیک و وزنه برداری ، برای افزایش میزان چسبیدن دست به وسایل ( دستگاهها و هالتر ) مورد استفاده قرار میگیرد.
سایر کاربردها عبارتند از فلاش دوربین عکاسی ، منور بمبهای آتشزا.
شناخت محیط رشد:منیزیم
منیزیم در تولید کلروفیل به کار می رود و در نتیجه عمل فتوسنتز موثر می باشد. در بذرها، منیزیم به مقدار زیاد یافت می شود. علایم کمبود منیزیم در گیاه زردی بین رگبرگهاست. علایم کمبود ابتدا در برگهای پیر مشاهده می شود. و در صورت کمبود شدید، برگ ها شروع به ریزش می کنند. در خاک منیزیم نسبتاً سریع شسته شده و از دسترس گیاه خارج میگردد. برای رفع کمبود منیزیم از کربنات و سولفات منیزیم استفاده می شود.
نام , علامت اختصاری , شماره Magnesium, Mg, 12
گروه شیمیایی فلز قلیائی خاکی
گروه , تناوب , بلوک 2 «IIA), 3 , s
جرم حجمی , سختی 1738 kg/m3, 2.5
رنگ سفید نقره ای
خواص اتمی
وزن اتمی 24.305 amu
شعاع اتمی (calc.) 150 pm (145 pm)
شعاع کووالانسی 130 pm
شعاع وندروالس 173 pm
ساختار الکترونی [Ne]3s2
-e بازای هر سطح انرژی 2, 8, 2
درجه اکسیداسیون (اکسید) 2 ( باز قوی)
ساختار کریستالی شش گوشه
خواص فیزیکی
حالت ماده جامد (پارا مگنتیسم)
نقطه ذوب 923 K (1202 °F)
نقطه جوش 1363 K (1994 °F)
حجم مولی 14.00 ש»10-6 ««متر مکعب بر مول
گرمای تبخیر 127.4 kJ/mol
گرمای همجوشی 8.954 kJ/mol
فشار بخار 361 Pa at 923 K
سرعت صوت 4602 m/s at 293.15 K
متفرقه
الکترونگاتیویته 1.31 (درجه پاولینگ)
ظرفیت گرمایی ویژه 1020 J/kg*K
رسانائی الکتریکی 22.6 106/m اهم
رسانائی الکتریکی 156 W/m*K)
1st پتانسیل یونیزاسیون 737.7 kJ/mol
2nd پتانسیل یونیزاسیون 1450.7 kJ/mol
3rd پتانسیل یونیزاسیون 7732.7 kJ/mol








 پاسخ با نقل قول
پاسخ با نقل قول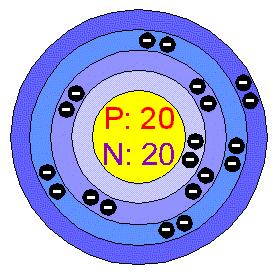



علاقه مندی ها (بوک مارک ها)