روشهای مختلفی برای جداسازی مواد اجزای سازنده یک محلول وجود دارد که یکی از این روشها فرایند تقطیر میباشد در روش تقطیر جداکردن اجزاء یک مخلوط ، از روی اختلاف نقطه جوش آنها انجام میگیرد .تقطیر ، در واقع ، جداسازی فیزیکی برشهای نفتی است که اساس آن ، اختلاف در نقطه جوش هیدروکربنهای مختلف است. هر چه هیدروکربن سنگینتر باشد، نقطه جوش آن زیاد است و هر چه هیدروکربن سبکتر باشد، زودتر خارج میشود.
تقطیر در عمل به دو روش زیر انجام میگیرد. روش اول شامل تولید بخار از طریق جوشاندن یک مخلوط مایع ، سپس میعان بخار ، بدون اینکه هیچ مایعی مجددا به محفظه تقطیر بازگردد. در نتیجه هیچ مایع برگشتی وجود ندارد. در روش دوم قسمتی از بخار مایع شده به دستگاه تقطیر باز میگردد و به صورتی که این مایع برگشتی در مجاورت بخاری که به طرف مبرد میرود قرار میگیرد. هر کدام از این روشها میتوانند پیوسته یا ناپیوسته باشند.
تقطیر، معمولترین روشی است که برای تخلیص مایعات به کار می رود. دراین عمل مایع را به کمک حرارت تبخیر می کنند و بخار مربوطه را در ظرف جداگانه ای متراکم می کنند و محصول تقطیر را بدست می آورند. چنانچه ناخالصیهای موجود در مایع اولیه فرار نباشند، در باقی مانده تقطیر به جا می مانند و تقطیر ساده جسم را خالص میکند. در صورتی که ناخالصیها فرار باشند، تقطیر جزء به جزء مورد احتیاج خواهد بود.
چنانچه ناخالصي هاي موجود در مايع اوليه فرار نباشد در باقيمانده تقطير به جا مي ماند و تقطير ساده نمونه را خالص مي كند. در صورتيكه فرار باشند تقطير جز به جز مورد نياز خواهد بود. اگر فقط يك ماده فرار بوده و اختلاف نقطه ي جوش اين ماده با ناخالصي هاي موجود در آن زياد باشد (حدود 30 درجه) مي توان براي جدا كردن اين ماده از ناخالصي ها از تقطير ساده استفاده نمود. از تقطير ساده معمولا در جداسازي مخلوط مايعاتي استفاده مي شود كه نقطه ي جوشي در محدوده 40 تا 150 درجه دارند زيرا در دماي بالاتر از 150 درجه بسياري از تركيبات آلي تجزيه مي شوند ودر دماي جوش كمتر از 40 درجه مقدار زيادي از مايع در ضمن تقطيرهدر مي رود.
در تقطير مخلوطي ازدو يا چند جسم فشاربخار كل تابعي از فشار بخار هر يك از اجزا و كسر مولي آنه مي باشد. بر اساس قانون رائول فشار بخار جزيي يك تركيب فرار در يك محلول ايده آل با حاصلضرب فشار بخار در كسر مولي آن برابر است. بنابراين در بخار موجود بر سطح دو يا چند جز محلول فرار ذرات كليه اجزا شركت كننده در محلول يافت مي شود. رابطه بين فشار بخار كل (Pt) با فشار جزيي (Pi) و كسر مولي اجزا (Xi) به صورت زير است:
...+Pt = PaXa + PbXb + PcXc
اگر در محلولي شامل دو ماده شيميايي فرار يك جز داراي فشار بخار بيشتري از جز ديگر باشد بخار حاصل از آن در مقايسه با مايع داراي درصد بيشتري از جسم فرارتر خواهد بود.
ظروف معمولي در خلل و شكاف هاي جدار خود داراي بسته ها ي هواي محبوس مي باشند. با ريختن مايع در ظرف محفظه بسته ها از بخار پر مي شود. وقتي كه دماي مايع افزايش مي يابد بخار آنقدر به حالت متراكم باقي مي ماند تا اينكه از فشار بخار روي مايع بيشتر شود در اين حالت بخار به دام افتاده افزايش حجم پيدا مي كند و به صورت حباب هايي به سطح مايع رسيده و خارج مي گردد. حالت به هم خوردگي حاصل از حباب ها (جوش) حباب هاي هواي بيشتري را به داخل مايع كشانده و فرايند با تشكيل بخار ادامه مي يابد.
با حرارت دادن مايعات درظروف شيشه اي كه داراي سطوحي نسبتا صاف و يكنواخت مي باشند حالت جوش ايجاد نمي شود و اگر درجه حرارت به اندازه كافي افزايش يابد به حالت انفجاري تبخير مي گردند. براي اجتناب از خطرات مربوط به جوشش ناگهاني (به صورت ضربه اي) منبعي براي دميدن حباب ها به درون مايع قبل از حرارت دادن و عمل جوش لازم است. در شرايط معمولي (فشارجو) اين منبع سنگ جوش مي باشد. سنگ جوش دانه هايي حاوي خلل ريز در خود بوده كه در آن مولكولهاي هوا حبس شده اند. با قرار گرفتن اين دانه ها در محلول حباب ها از سطح آنها تشكيل شده و از جوشيدن انفجاري و تاخير در جوش جلوگيري مي نمايد.
انواع تقطیر :
تقطير ساده:
به عنوان مثال هنگاميكه ناخالصي غير فراري مانند شكر به مايع خالصي اضافه مي شود فشار بخار مايع تنزل مي يابد. علت اين عمل آن است كه وجود جز غير فرار به مقدار زيادي غلظت جز اصلي فرار را پايين مي آورد يعني ديگر تمام مولكولهايي كه در سطح مايع موجودند مولكولهاي جسم فرار نيستند و بدين ترتيب قابليت تبخير مايع كم مي شود.
تقطير ساده را مي توان به دوصورت تعريف كرد :
تقطير ساده غير مداوم
تقطير ساده مداوم
تقطیر ساده غیر مداوم :
در این روش تقطیر ، مخلوط حرارت داده میشود تا بحال جوش درآید بخارهایی که تشکیل میشود غنی از جزء سبک مخلوط میباشد پس از عبور از کندانسورها ( میعان کننده ها ) تبدیل به مایع شده ، از سیستم تقطیر خارج میگردد. به تدریج که غلظت جزء سنگین مخلوط در مایع باقی مانده زیاد میشود، نقطه جوش آن بتدریج بالا میرود. به این ترتیب ، هر لحظه از عمل تقطیر ، ترکیب فاز بخار حاصل و مایع باقی مانده تغییر میکند.
تقطیر ساده مداوم :
در این روش ، مخلوط اولیه (خوراک دستگاه) بطور مداوم با مقدار ثابت در واحد زمان ، در گرم کننده گرم میشود تا مقداری از آن بصورت بخار درآید، و به محض ورود در ستون تقطیر ، جزء سبک مخلوط بخار از جزء سنگین جدا می شود و از بالای ستون تقطیر خارج میگردد و بعد از عبور از کندانسورها ، به صورت مایع در میآید جزء سنگین نیز از ته ستون تقطیر خارج میشود. قابل ذکر است که همیشه جزء سبک مقداری جزء سنگین و جزء سنگین نیز دارای مقداری از جزء سبک است.
در تقطير يك ماده خالص چنانچه مايع زياده از حد گرم نشود درجه حرارتي كه در گرماسنج ديده مي شود يعني درجه حرارت دهانه ي خروجي با درجه حرارت مايع جوشان در ظرف تقطير يعني درجه حرارت ظرف يكسان است. درجه حرارت دهانه خروجي كه به اين ترتيب به نقطه جوش مايع مربوط مي شود در طول تقطير ثابت مي ماند.
هرگاه در مايعي که تقطير مي شود ناخالصي غير فراري موجود باشد درجه حرارت دهانه خروجي همان درجه حرارت مايع خالص است زيرا ماده اي كه بر روي حباب گرماسنج متراكم مي شود به ناخالصي آلوده نيست. ولي درجه حرارت ظرف به علت كاهش فشار بخار محلول بالا مي ررود. در جريان تقطير درجه حرارت ظرف نيز افزايش مي يابد.زيرا كه غلظت ناخالصي با تقطير جز فرار به تدريج زياد مي شود و فشار بخار مايع بيشتر پايين مي ايد ، با وجود اين درجه حرارت دهانه خروجي مانند مايع خالص ثابت مي ماند. رابطه كمي موجود بين فشار بخار وتركيب مخلوط همگن مايع (محلول) به قانون رائول معروف است.
تقطیر تبخیر آنی (ناگهانی):
وقتی محلول چند جزئی مانند نفت خام را حرارت میدهیم ، اجزای تشکیل دهنده آن بترتیب که سبکتر هستند، زودتر بخار میشود. برعکس وقتی بخواهیم این بخارها را سرد و دوباره تبدیل به مایع کنیم، هر کدام که سبکتر باشد دیرتر مایع میگردد. با توجه به این خاصیت ، میتوانیم نفت خام را به روش دیگری که به آن "تقطیر آنی" گویند، تقطیر نماییم. در این روش ، نفت خام را چنان حرارت میدهیم که ناگهان همه اجزای آن تبدیل به بخار گردد و سپس آنها را سرد میکنیم تا مایع شود. در اینجا ، بخارها به ترتیب سنگینی ، مایع میشوند یعنی هرچه سنگینتر باشند، زودتر مایع میگردند و بدین گونه ، اجزای نفت خام را با ترتیب مایع شدن از هم جدا میکنیم.
تقطیر در خلا :
با توجه به اینکه نقطه جوش مواد سنگین نفتی نسبتا بالاست و نیاز به دما و انرژی بیشتری دارد، و از طرف دیگر ، مقاومت این مواد در مقابل حرارت بالا کمتر میباشد و زودتر تجزیه میگردند، لذا برای جداکردن آنها از خلا نسبی استفاده میشود. در این صورت مواد دمای پایینتر از نقطه جوش معمولی خود به جوش میآیند. در نتیجه ، تقطیر در خلا ، دو فایده دارد: اول این که به انرژی و دمای کمتر نیاز است، دوم اینکه مولکولها تجزیه نمیشوند. امروزه در بیشتر موارد در عمل تقطیر ، از خلا استفاده میشود. یعنی این که: هم تقطیر جزء به جزء و هم تقطیر آنی را در خلا انجام میدهند.
تقطیر به کمک بخار آب :
یکی دیگر از طرق تقطیر آن است که بخار آب را در دستگاه تقطیر وارد میکنند در این صورت بی آنکه خلاءای ایجاد گردد، اجزای نفت خام در درجه حرارت کمتری تبخیر میشوند. این مورد معمولا در زمانی انجام میشود که در نقطه جوش آب ، فشار بخار اجزای جدا شونده بالا باشد تا به همراه بخار آب از مخلوط جدا گردند.
غالبابه كمك تقطير با بخار آب مي توان تركيبات آلي فراري را كه با آب مخلوط نمي شوند يا تقريبا با آن غير قابل اختلاط هستند تفكيك و تخليص كرد. در اين روش مخلوط آب وجسم آلي با هم تقطير مي شوند.عمل تقطير يك مخلوط غير قابل امتزاج در صورتي كه يكي از اجزا آب باشد تقطير با بخار آب ناميده مي شود.
تقطیر آزئوتروپی :
از این روش تقطیر معمولا در مواردی که نقطه جوش اجزاء مخلوط بهم نزدیک باشند استفاده میشود، جداسازی مخلوط اولیه ، با افزایش یک حلال خاص که با یکی از اجزای کلیدی ، آزئوتوپ تشکیل میدهد امکانپذیر است. آزئوتروپ محصول تقطیر یا ته مانده را از ستون تشکیل میدهد و بعد حلال و جزء کلیدی را از هم جدا میکند. اغلب ، ماده افزوده شده آزئوتروپی با نقطه جوش پایین تشکیل میدهد که به آن شکننده آزئوتروپ میگویند. آزئوتروپ اغلب شامل اجزای خوراک است، اما نسبت اجزای کلیدی به سایر اجزای خوراک خیلی متفاوت بوده و بیشتر است.
مثالی از تقطیر آزئوتروپی استفاده از بنزن برای جداسازی کامل اتانول از آب است، که آزئوتروپی با نقطه جوش پایین با 6/95% وزنی الکل را تشکیل میدهد. مخلوط آب- الکل با 95% وزنی الکل به ستون تقطیر آزئوتروپی افزوده میشود و جریان جریان غنی از بنزن از قسمت فوقانی وارد میشود. محصول ته مانده الکل تقریبا خالص است وبخار بالایی یک آزئوتروپی سهگانه است. این بخار مایع شده، به دو فاز تقسیم میشود. لایه آلی برگشت داده شده، لایه آلی به ستون بازیافت بنزن فرستاده میشود. همه بنزن و مقدار الکل در بخار بالایی گرفته شده، به ستون اول روانه میشوند. جریان انتهایی در ستون سوم تقطیر میشود تا آب خالص و مقداری آزئوتروپ دوگانه از آن بدست آید.
تقطیر استخراجی :
جداسازی اجزای با نقطه جوش تقریبا یکسان از طریق تقطیر ساده مشکل است حتی اگر مخلوط ایده آل باشد و به دلیل تشکیل آزئوتروپ ، جداسازی کامل آنها غیر ممکن است برای چنین سیستم هایی با افزایش یک جزء سوم به مخلوط که باعث تغییر فراریت نسبی ترکیبات اولیه میشود، جداسازی ممکن میشود. جزء افزوده شده باید مایعی با نقطه جوش بالا باشد، قابلیت حل شدن در هر دو جزء کلیدی را داشته باشد و از لحاظ شیمیایی به یکی از آنها شبیه باشد. جزء کلیدی که به حلال بیشتر شبیه است ضریب فعالیت پایین تری از جزء دیگر محلول دارد، در نتیجه جداسازی بهبود می یابد این فرآیند ، تقطیر استخراجی نام دارد.
مثالی از تقطیر استخراجی، استفاده از فور فورال در جداسازی بوتادیان و بوتن است، فورفورال که حلالی به شدت قطبی است، فعالیت بوتادی ان را بیش تر از بوتن و بوتان کم میکند و غلظت بوتادی ان وفورفورال وارد قسمت فوقانی ستون تقطیر استخراجی شود، با انجام تقطیر بوتادی ان از فورفورال جدا میشود.
تقطیر جزء به جزء :
اجزای سازنده محلول شامل دو یا چند فرار را که از قانون رائول پیروی میکنند، میتوان با فرایند تقطیر جزء به جزء از هم جدا کرد. طبق قانون رائول ، فشار بخار محلول برابر با مجموع اجزای سازنده آن است و سهم هر جزء برابر با حاصلضرب کسر مولی آن جزء به جزء در فشار بخار آن در حالت خاص است. در تقطیر محلولی از B و A ، غلظت A در بخاری که خارج شده و مایع میشود، بیش از غلظت آن در مایع باقی مانده است. با ادامه عمل تقطیر ، ترکیب درصد اجزا در بخار و مایع دائما تغییر میکند و این در هر نقطه عمومیت دارد. با جمع آوری مایعی که از سردشدن بخار حاصل میشود و از تقطیر مجدد آن و با تکراری پی در پی این عمل ، سرانجام میتوان اجزای سازنده مخلوط اصلی را به صورتی واقعا خالص بدست آورد.
از نظر سهولت در اينجا فقط محلولهاي ايده آل دو تايي را كه محتوي دو جز فرار RوS باشند در نظر مي گيريم. محلول ايده ال به محلولي اطلاق مي شود كه در آن اثرات بين مولكولهاي متجانس مشابه با اثرات بين مولكولهاي غير متجانس باشد.گرچه فقط محلولهاي ايده ال به طور كامل از قانون رائول پيروي مي كنند ولي بسياري از محلولهاي آلي به محلولهلي ايده آل نزديك هستند.
تقطير جزبه جز محلول هاي غير ايده ال
گرچه بيشتر مخلوط هاي يكنواخت مايع به صورت محلولهاي ايده ال عمل مي كنند ولي نمونه هاي بسياري وجود دارد كه نحوه عمل آنها ايده آل نيست.در اين محلولها مولكولهاي غير متجانس در مجاورت يكديگر به طور يكسان عمل نمي كنند انحراف حاصل از قانون رائول به دو روش انجام ميگيرد:
بعضي از محلولها فشار بخار بيشتري از فشار بخار پيش بيني شده ظاهر مي سازندوگفته مي شود كه انحراف مثبت دارند. بعضي ديگر فشار بخار كمتري از فشار پيش بيني شده آشكار مي كنندومي گويند كه انحراف منفي نشان مي دهند.
در انحراف مثبت نيروي جاذبه بين مولكولهاي مختلف دو جز سازنده ضعيف تر از نيروي جاذبه بين مولكولهاي مشابه يك جز است و در نتيجه در حدود تركيب درصد معيني فشار بخار مشترك دو جز بزرگتر از فشار بخار جز خالصي مي شود كه فرارتر است. بنابراين مخلوط هايي كه تركيب درصد آنها در اين حدود باشد درجه جوش كمتري از هر يك از دو جز خالص دارند.مخلوطي كه در اين حدود حداقل درجه جوشش را دارد بايد به صورت جز سوم در نظر گرفته شود.اين مخلوط نقطه جوش ثابتي دارد زيرا تركيب درصد بخاري كه در تعادل با مايع است با تركيب درصد خود مايع برابر است.چنين مخلوطي را آزئوتروپ يا مخلوط آزئوتروپ با جوشش مينيمم مي نامند. از تقطير جز به جز اين مخلوط ها هر دو جز به حالت خالص به دست نمي آيد بلكه جزيي كه تركيب درصد آن از تركيب درصد آزئوتروپ بيشتر باشد توليد مي شود.
در انحراف منفي از قانون رائول نيروي جاذبه بين مولكولهاي مختلف دو جز قويتر از نيروي جاذبه بين مولكولهاي مشابه يك جز است ودر نتيجه تركيب درصد معيني فشار بخار مشترك دو جز كمتر از فشار بخار جز خالص مي شود كه فرارتر است.بنابراين مخلوط هايي كه تركيب درصد آنها در اين حدود باشد حتي نسبت به جز خالصي كه نقطه جوش بيشتري دارد در درجه حرارت بالاتري مي جوشند.در اينجا تركيب درصد به خصوصي وجود دارد كه به آزئو تروپ با جوشش ماكسيمم مربوط مي شود. تقطير جز به جز محلولهايي كه تركيب درصدي غير از تركيب درصد آزئوتروپ دارندباعث خروج جزيي مخلوط مي شود كه تركيب درصد آن از آزئوتروپ بيشتر باشد.
ستونهاي تقطيرجز به جز:
اين ستونها انواع متعددي دارد ولي در تمام آنها خصلت هاي مشابهي وجود دارد. اين ستونها مسير عمودي را به وجود مي آورند كه بايد بخار در انتقال از ظرف تقطير به مبرد از آن بگذرد. اين مسير به مقدار قابل ملاحظه اي از مسير دستگاه تقطير ساده طويل تر است. هنگام انتقال بخار از ظرف تقطير به بالاي ستون مقداري از بخار متراكم مي شود.چنان چه قسمت پايين اين ستون نسبت به قسمت بالاي آن در درجه حرارت بيشتري نگه داري شود مايع متراكم شده و در حالي كه به پايين ستون مي ريزد دوباره به طور جزيي تبخير مي شود .بخار متراكم نشده همراه بخاري كه از تبخير مجدد مايع متراكم شدهحاصل مي شود در داخل ستون بالاتر مي رود واز يك سري تراكم وتبخير مي گذرد. اين اعمال باعث تقطير مجدد مايع مي شود و به طوريكه در هر يك از مراحل فاز بخاري كه به وجود مي آيد نسبت به جز فرارتر غني تر مي شود.ماده متراكم شده اي كه به پايين ستون مي ريزددر مقايسه با بخاري كه با آن در تماس است در هر يك از مراحل نسبت جزيي كه فراريت كمتري دارد غني تر مي شود.
در شرايط ايده ال بين فازهاي مايع و بخار در سراسر ستون تعادل برقرار مي شود و فاز بخار بالايي تقريبا به طور كامل از جز فرارتر تشكيل مي شود و فاز مايع پاييني نسبت به جزيي كه فراريت كمتري دارد غني تر مي شود.
مهم ترين شرايطي كه براي ايجاد اين حالت لازم است عبارتند از :
تماس كامل و مداوم بين فازهاي بخار و مايع در ستون
حفظ افت مناسبي از درجه حرارت در طول ستون
طول كافي ستون
اختلاف كافي در نقاط جوش اجزاي مخلوط مايع
چنانچه دو شرط اول كاملا مراعات شود مي توان با يك ستون طويل تركيباتي كه اختلاف كمي در نقطه ي جوش دارند به طور رضايت بخش از هم جدا كرد زيرا طول ستون مورد لزوم و اختلاف نقاط جوش اجزا با هم نسبت عكس دارند. معمولترين راه ايجاد تماس لازم در بين فازهاي مايع آن است كه ستون با مقداري ماده بي اثر مانند شيشه يا سراميك يا تكه هاي فلزي به اشكال مختلف كه سطح تماس وسيعي را فراهم مي كند پر شود. يكي از راه هاي بسيار موثر ايجاد اين تماس بين مايع و بخار آن است كه نوار چرخاني از فلز يا تفلون كه با سرعت زيادي در داخل ستون بچرخد به كار رود.
اين عمل نسبت به ستون هاي پر شده اي كه قدرت مشابهي دارند اين مزيت را دارد كه ماده كمي را در داخل ستون نگاه مي دارد (منظور از اين نگه داري مقدار مايع و بخاري است كه براي حفظ شرايط تعادل در داخل ستون لازم است.)
تقطیر تبخیر ناگهانی
در این نوع تقطیر ، مخلوطی از مواد نفتی که قبلا در مبدلهای حرارتی و یا کوره گرم شدهاند، بطور مداوم به ظرف تقطیر وارد میشوند و تحت شرایط ثابت ، مقداری از آنها به صورت ناگهانی تبخیر میشوند. بخارات حاصله بعد از میعان و مایع باقیمانده در پایین برج بعد از سرد شدن به صورت محصولات تقطیر جمع آوری میشوند. در این نوع تقطیر ، خلوص محصولات چندان زیاد نیست.
تقطیر با مایع برگشتی ( تقطیر همراه با تصفیه )
در این روش تقطیر ، قسمتی از بخارات حاصله در بالای برج ، بعد از میعان به صورت محصول خارج شده و قسمت زیادی به داخل برج برگردانده میشود. این مایع به مایع برگشتی موسوم است. مایع برگشتی با بخارات در حال صعود در تماس قرار داده میشود تا انتقال ماده و انتقال حرارت ، صورت گیرد. از آنجا که مایعات در داخل برج در نقطه جوش خود هستند، لذا در هر تماس مقداری از بخار، تبدیل به مایع و قسمتی از مایع نیز تبدیل به بخار میشود.
نتیجه نهایی مجوعه این تماسها ، بخاری اشباع از هیدروکربنهای با نقطه جوش کم و مایعی اشباع از مواد نفتی با نقطه جوش زیاد میباشد. در تقطیر با مایع برگشتی با استفاده از تماس بخار و مایع ، میتوان محصولات مورد نیاز را با هر درجه خلوص تولید کرد، مشروط بر اینکه به مقدار کافی مایع برگشتی و سینی در برج موجود باشد. بوسیله مایع برگشتی یا تعداد سینیهای داخل برج میتوانیم درجه خلوص را تغییر دهیم. لازم به توضیح است که ازدیاد مقدار مایع برگشتی باعث افزایش میزان سوخت خواهد شد. چون تمام مایع برگشتی باید دوباره به صورت بخار تبدیل شود.
امروزه به علت گرانی سوخت ، سعی میشود برای بدست آوردن خلوص بیشتر محصولات ، به جای ازدیاد مایع برگشتی از سینیهای بیشتری در برجهای تقطیر استفاده شود. زیاد شدن مایع برگشتی موجب زیاد شدن انرژی میشود. برای همین ، تعداد سینیها را افزایش میدهند. در ابتدا مایع برگشتی را صد درصد انتخاب کرده و بعد مرتبا این درصد را کم میکنند و به صورت محصول خارج میکنند تا به این ترتیب دستگاه تنظیم شود.
انواع مایع برگشتی
• مایع برگشتی سرد:
این نوع مایع برگشتی با درجه حرارتی کمتر از دمای بالای برج تقطیر برگردانده میشود. مقدار گرمای گرفته شده ، برابر با مجموع گرمای نهان و گرمای مخصوص مورد نیاز برای رساندن دمای مایع به دمای بالای برج است.
• مایع برگشتی گرم:
مایع برگشتی گرم با درجه حرارتی برابر با دمای بخارات خروجی برج مورد استفاده قرار میگیرد.
• مایع برگشتی داخلی:
مجموع تمام مایعهای برگشتی داخل برج را که از سینیهای بالا تا پایین در حرکت است، مایع برگشتی داخلی گویند. مایع برگشتی داخلی و گرم فقط قادر به جذب گرمای نهان میباشد. چون اصولا طبق تعریف اختلاف دمایی بین بخارات و مایعات در حال تماس وجود ندارد.
• مایع برگشت دورانی:
این نوع مایع برگشتی ، تبخیر نمیشود. بلکه فقط گرمای مخصوص معادل با اختلاف دمای حاصل از دوران خود را از برج خارج میکند. این مایع برگشتی با دمای زیاد از برج خارج شده و بعد از سرد شدن با درجه حرارتی کمتر به برج برمیگردد. معمولا این نوع مایع برگشتی درقسمتهای میانی یا درونی برج بکار گرفته میشود و مایع برگشتی جانبی هم خوانده میشود. اثر عمده این روش ، تقلیل حجم بخارات موجود در برج است.
نسبت مایع برگشتی
نسبت حجم مایع برگشتی به داخلی و محصول بالایی برج را نسبت مایع برگشتی گویند. از آنجا که محاسبه مایع برگشتی داخلی نیاز به محاسبات دقیق دارد، لذا در پالایشگاهها ، عملا نسبت مایع برگشتی بالای برج به محصول بالایی را به عنوان نسبت مایع برگشتی بکار میبرند.
تقطیر نوبتی
این نوع تقطیرها در قدیم بسیار متداول بوده، ولی امروزه بعلت نیاز نیروی انسانی و ضرورت ظرفیت زیاد ، این روش کمتر مورد توجه قرار میگیرد. امروزه تقطیر نوبتی ، صرفا در صنایع دارویی و رنگ و مواد آرایشی و موارد مشابه بکار برده میشود و در صنایع پالایش نفت در موارد محدودی مورد استفاده قرار میگیرد. بنابراین در موارد زیر ، تقطیر نوبتی از نظر اقتصادی قابل توجه میباشد.
• تقطیر در مقیاس کم
• ضرورت تغییرات زیاد در شرایط خوراک و محصولات مورد نیاز
• استفاده نامنظم از دستگاه
• تفکیک چند محصولی
• عملیات تولید متوالی با فرآیندهای مختلف
تقطیر مداوم
امروزه بعلت اقتصادی بودن مداوم در تمام عملیات پالایش نفت از این روش استفاده میشود. در تقطیر مداوم برای یک نوع خوراک مشخص و برشهای تعیین شده شرایط عملیاتی ثابت بکار گرفته میشود. بعلت ثابت بودن شرایط عملیاتی در مقایسه با تقطیر نوبتی به مراقبت و نیروی انسانی کمتری احتیاج است. با استفاده از تقطیر مداوم در پالایشگاهها مواد زیر تولید میشود:
گاز اتان و متان بعنوان سوخت پالایشگاه ، گاز پروپان و بوتان بعنوان گاز مایع و خوراک واحدهای پتروشیمی ، بنزین موتور و نفتهای سنگین بعنوان خوراک واحدهای تبدیل کاتالیستی برای تهیه بنزین با درجه آروماتیسیته بالاتر ، حلالها ، نفت سفید ، سوخت جت سبک و سنگین ، نفت گاز ، خوراک واحدهای هیدروکراکینگ و واحدهای روغن سازی ، نفت کوره و انواع آسفالتها.
● كتاب شيمي آلي تجربي نوين / جلد اول وجلد دوم / نويسندگان: رابرتس- گيلبرت-ردوالد- وينگرو / مترجم: هوشنگ پير الهي
● كتاب شيمي عملي و آلي / مولفين: آقايان جليليان- وارسته مرادي- احمدي گلسفيدي





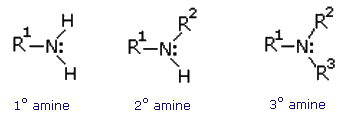
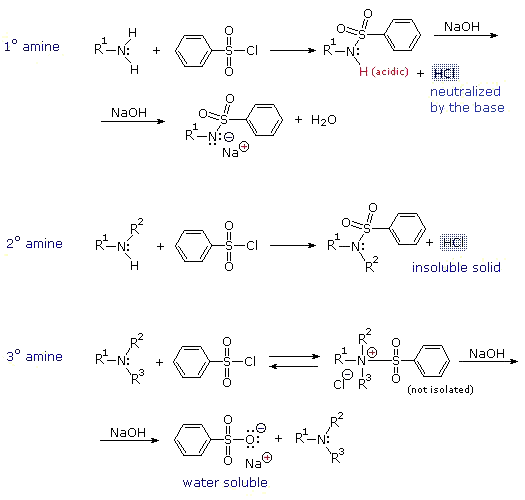

 پاسخ با نقل قول
پاسخ با نقل قول


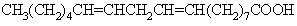




علاقه مندی ها (بوک مارک ها)