اساسآ کاتالیزوربه عنوان يک ترکيب شيميايي در نظر گرفته مي شود که قادر به اعمال اثر تسريع کنندگي و اثر جهت دهندگي بر پيشرفت واکنشي باشد که از نظر ترموديناميکي امکان پذير است. هنگامي که کاتاليزور به صورت محلول در محيط واکنشي است "کاتاليزور همگن" و وقتي که کاتاليزور فازي مجزا از فاز واکنش تشکيل ميدهد "کاتاليزور ناهمگن" ناميده مي شود.
در اکثر موارد کاتاليزور ناهمگن، کاتاليزور جامدي است که از تماس با آن واکنش گرهاي گازي يا مايع، متحول مي شوند و در نتيجه خيلي اوقات عبارت "کاتاليست" براي ناميدن کاتاليزور ناهمگن به کار مي رود .
بطور کلي کاتاليستها به سه دسته تقسيم مي شوند:
1- کاتاليستهاي فلزي، از قبيل Fe، Co، Ni، Rh، Pt و غيره.
2- کاتاليستهاي عايق، از قبيل سيليکا، آلومينا، زئوليتها و آلوميناي فعال شده. (اين نوع کاتاليستها نسبت به آمونياک و بازهاي الي حساس هستند.)
3- کاتاليستهاي نيمه هادي، از قبيل اکسيدهاي فلزي و سولفيدها.
واکنشهای کاتالیزوری جامد
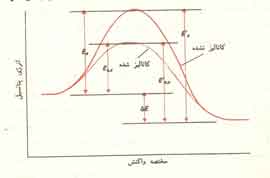
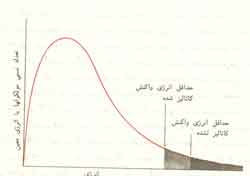
این واکنشها دوفازی هستند که کاتالیست فاز جامد، و ترکیب شونده ها و محصولات، فاز سیال می ¬باشند. اصولآ واکنشهای کاتالیزوری شامل شکسته شدن یا سنتز مولکولها است و معمولآ این واکنشها انرژی اکتیواسیون بالایی دارند و در نتیجه بدون وجود یک ماده تسریع کننده، انجام واکنش ممکن نیست. مانند تولید امونیاک.
یکی از مهمترین خواصی که باید کاتالیستها داشته باشند، مسئله انتخاب پدیری(Selecting) آنهاست. یعنی کاتالیستها بین صدها واکنش که ممکن است صورت گیرد، فعل وانفعالی که ما می خواهیم را تسریع کند و معمولآ واکنشها و کاتالیستهای حیاتی، صددرصد چنین وضعیتی را دارند، مثل آنزیمها.
در بعضی موارد انتخاب کاتالیزور مبنای علمی دارد. اگر واکنش هیدروژناسیون باشد از Pt استفاده می شود، اگر اکسید کنندگی باشد از مولیبدن، اهن، نقره و... استفاده می شود و در خیلی از موارد انتخاب کاتالیزور به صورت حدس و خطاست.
کاتالسیتهای جامد از مراکز فعالی (Active Site) تشکیل شده اندکه این مراکز هم روی سطح خارجی هستند و اگر متخلخل باشند، در داخل تخلخل هم هست. وقتی مولکولها به نقاط فعال نزدیک می شوند، طبق یک تئوری مولکولی جذب سطحی مراکز فعال می شود و به صورت یک ماده واسطه درمی اید. در تئوری دیگر، مولکولها تحت تأثیر نقاط فعال قرار می گیرند ولی جذب نمی شوند (تحت تأثیر نیروها هستند) و تحرکشان کم می شود و انرژیشان تغییر می کند و به صورت یک ماده واسطه در می آیند. در تئوری دیگر، ماده جذب مراکز فعال می شود، تبدیل به ماده واسطه شده و به صورت یک ریشه آزاد وارد فاز سیال شده و واکنش انجام می گیرد. در تئوری اول و دوم فعل و انفعال در حوالی نقاط فعال صورت می گیرد و در تئوری سوم واکنش در توده سیال صورت می پذیرد
مشخصات اصلی کاتالیستها
1- در طی واکنش، کاتالیست بدون تغییر باقی می ماند وتنها سرعت واکنش را افزایش می دهد.
2- هنگامی که سازوکارهای متعددی برای انجام واکنش موجود باشند، کاتالیست بایستی خاصیت انتخاب پذیری داشته باشد. در اصل بایستی کاتالیست نسبت تولید ماده مطلوب را نسبت به ماده ناخواسته افزایش دهد.
3- سرعت واکنش متناسب با غلظت کاتالیست است و برای واکنشهای گاز-جامد، سطح کاتالیست وسطوح فعال بسیار مهم است.
4- در یک واکنش برگشت پذیر کاتالیست به همان نسبت که سرعت واکنش رفت را افزایش می دهد، بر سرعت واکنش برگشت هم مؤثر است. بنابراین ترکیبی درصد تعادلی سیستم چه در حضور کاتالیست و چه بدون آن یکسان است.
5- در واکنشهای اتوکاتالیستی مقدار کمی از محصول بایستی در ابتدا وجود داشته باشد.






 پاسخ با نقل قول
پاسخ با نقل قول




علاقه مندی ها (بوک مارک ها)