هدف از آزمايش: ارائه يک ديد عملي از قانون فوريه و بدست آوردن مقدار K براي فلزات مي باشد.
انتقال گرما ، گذار انرژي بر اثر اختلاف دما است . اختلاف دما به عنوان يک نيروي محرکه ( Driving Force ( سبب انتقال گرما مي شود . حرکت مولکول ها در کنار هم و ارتعاش آنها سبب مي شود که گرما از يک مولکول به مولکول مجاور منتقل شده و در نتيجه گرما منتقل مي گردد .
هرگاه در يك محيط يا ميان دو محيط اختلاف دما وجود داشته باشد و دماي محيط ها يکسان نباشد ، انتقال گرما رخ مي دهد .
انواع مختلف انتقال گرما را شيوه هاي آن مي گويند يعني راه هاي انتقال گرما را شيوه هاي آن مي گويند .
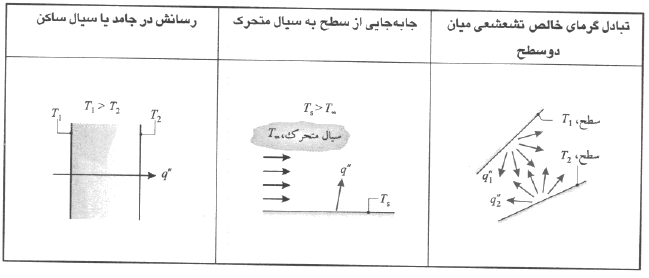
وقتي در محيط ساكني ، كه مي تواند جامد يا سيال باشد ، شيب دما وجود داشته باشد ، براي انتقال گرمايي كه در محيط روي مي دهد از واژه رسانش ( Conduction) و براي انتقال گرماي بين سطح و سيالي متحرك ، كه دماي آنها با هم متفاوت است ، از واژه جابجايي ( Convection) استفاده مي شود . نوع سوم انتقال گرما تشعشع گرمايي ( Radiation ) است .
تمام سطوح با دماي معين انرژي را به شكل امواج الكترومغناطيس گسيل مي دارند يعني هر سطح در هر دمايي مي تواند از خود تابش ايجاد کند . از اين رو ، در نبود محيط واسط ، ميان دو سطح با دماهاي مختلف انتقال گرماي خالص تشعشعي وجود دارد و اگر هم ميان دو سطح محيط واسطي وجود داشته باشد انتقال گرما مي تواند از طريق رسانش و يا جابجايي و يا هر دو اينها صورت بگيرد . در زير راههاي مختلف انتقال گرما را بررسي مي کنيم .
تئوري
براي انتقال گرما روش هاي متعددي وجود دارد که ذکر شد در اينجا به شرح اين سه روش مي پردازيم .
رسانش :
رسانش مستقيماً به حرکت مولکولها و اتمها وابسته است اين فرايندها در سطح مولکولي و اتمي است كه اين نوع انتقال گرما را تداوم مي بخشند . رسانش را به عنوان انتقال انرژي از ذرات پر انرژي به ذرات كم انرژي ماده ، بر اثر بر هم كنش هاي بين آنها مي توان دانست يعني در اين شيوه برخورد اتمها و يا مولکولهاي مجاور به همديگر سبب انتقال گرما مي گردد .
با در نظر گرفتن يك گاز و با استفاده از مفاهيم ترموديناميكي ، مكانيزم فيزيكي رسانش به ساده ترين وجه توضيح داده مي شود . گازي را در نظر مي گيريم كه در آن شيب دما وجود دارد يعني ميان دو نقطه از آن اختلاف دما وجود دارد و فرض كنيم كه هيچ حركت كپه اي وجود ندارد گاز مي تواند فضاي بين دو سطحي را ، كه در دما هاي متفاوت قرار دارند ، اشغال كند . دما در هر نقطه به انرژي مولكول هاي گاز موجود در مجاو.رت آن نقطه نسبت داده مي شود . اين انرژي به حركت هاي انتقالي تصادفي و همچنين به حركت هاي چرخشي و نوساني مولكول ها ارتباط دارد .
دماهاي بالاتر به انرژي هاي مولكولي بالاتر نسبت داده مي شود ، و با برخورد مولكول ها به يكديگر
( پديده اي كه دائماً روي مي دهد ) ، انرژي از مولكول هاي پر انرژي به مولكول هاي كم انرژي منتقل مي شود . بنابراين وقتي شيب دما وجود دارد ، انتقال انرژي رسانشي در جهت كاهش دما روي مي دهد . در شكل ( a ) مولكول ها صفحه فرضي xo را از بالا و پايين با حركت تصادفي خود دائماً قطع مي كنند . ولي ، مولكول هاي بالايي از مولكول هاي پاييني دماي بيشتري دارند . بنابراين در اين حالت ، انتقال خالص انرژي در جهت x مثبت وجود دارد . انتقال خالص انرژي توسط حركت تصادفي مولكولي را پخش انرژي مي گويند .
در مايعات نيز وضع به همين منوال است ، ولي مولكول ها به هم نزديكترند و بر هم كنش هاي مولكولي قويتر و تكراري تر است . بطور مشابه ، رسانش در اجسام جامد را به فعاليت اتمي ، به شكل ارتعاشات شبكه اي ،
مي توان نسبت داد . در ديدگاه جديد ، انتقال انرژي را به امواج شبكه اي ، كه با حركت اتمي ايجاد مي شود ، ارتباط مي دهد . در نارساناها ، انتقال انرژي توسط حركت انتقالي الكترون هاي آزاد نيز روي مي دهد .
فرايند هاي انتقال گرما را بر حسب معادله هاي آهنگ مربوط مي توان بطور كمي بيان كرد . از اين معادله ها براي محاسبه مقدار انتقال انرژي در زمان واحد مي توان استفاده كرد . معادله آهنگ رسانش گرما توسط قانون فوريه به دست داده مي شود . قانون فوريه بيان مي کند که شار گرماي به وجود آمده در يک رسانا متناسب است با اختلاف دماي دو سر رسانا و با ظول آن رسانا نسبت عکس دارد با در نظر گرفتن ثابت يا همان ضريب ثابتي مي توان اين تناسب را به تساوي تبديل کرد براي سطح مسطحي يك بعدي شکل ( c ) كه توزيع دماي( T(x را دارد ، معادله آهنگ بصورت زير است :
شار گرماي عبارت است از آهنگ انتقال گرما در جهت x براي مساحت واحد عمود بر جهت انتقال ، كه با شيب دما ، dT/dx ، در اين جهت متناسب است . ثابت تناسب k يك خاصيت انتقال است و به آن رسانندگي گرمايي ( W/m.K) مي گويند و مشخصه اي از مواد ديوار است . علامت منفي به اين دليل است كه گرما در جهت كاهش دما منتقل مي شود . با دو فرض خطي بودن توزيع دما و پايدار بودن حالت تحليل مساله مي توان رابطه زير را به دست آورد .
با داشتن اين دو رابطه مي توان معادله شار گرما را با داشتن ضريب تناسب و دماهاي دو طرف سطح و ضخامت سطح يافت .که در اين رابطه منظور از x انتقال حرارت در راستاي x است از معادله بالا شار گرما ، يعني آهنگ انتقال گرما براي مساحت واحد ، بدست مي آيد . با ضرب اين شار گرمايي در مساحت سطح مورد بحث مي توان مقدار گرماي مورد نظر را يافت .
جابجايي : ( Convection )
گرما از طريق جابجايي نيز منتقل مي گردد در اين شيوه حرکت مولکولها و ارتعاشات مولکولها سبب انتقال گرما نيز مي شود .
عده زيادي از مولکولها که در کنار يک سطح قرار گرفته اند با آن سطح در تبادل دمايي هستند و با آن سطح همدما مي شوند . اين عده به علت تفاوت درمايي در بين دو نقطه از سيال از جاي خود حرکت کرده و به آنجايي که دماي کمتري دارد منتقل مي گردند . اين انتقال همراه با حمل گرما توسط اين مولکول ها همراه است و به اين ترتيب مولکولها گرما را از يک نقطه با دماي بيشتر به نقطه ديگري با دماي کمتر منتقل مي کنند . اين حرکت توده مولکولها را حرکت کپه اي مي نامند . پس انتقال گرما در پديده جابجايي حاصل ترکيب دو نوع انتقال گرماي رسانش و گرماي ناشي از اين حرکت کپه اي است .
معمولاً از واژه كنوكسيون براي اين انتقال تركيبي و از واژه ادوكسيون براي انتقال ناشي از حركت كپه اي سيال استفاده مي شود .
در پديده جابجايي بايد سيال داراي حرکت باشد و از طرفي دماي سطح و سيال با هم ديگر تفاوت داشته باشند اگر سيال داراي حرکت نباشد مکانيسم انتقال حرارت بيشتر توسط رسانش صورت مي گيرد هرچند که جابجايي طبيعي نيز بايد مورد توجه قرار گيرد و اگر دماها برابر باشند به علت نبودن گراديان دمايي هيچ گونه انتقال حرارتي انجام نمي گيرد .
اگر دماي سطح از دماي سيال بيشتر باشد جهت انتقال دما از سطح به سيال است و اگر دماي سيال از دماي سطح بيشتر باشد جهت انتقال گرما برعکس مي شود .
در عبور سيال از يک سطح با دماهاي متفاوت مي توان دو لايه مرزي را براي فرايند متصور شد يک لايه مرزي سرعت و ديگري لايه مرزي حرارت که اين دو لايه ممکن است بر هم افتاده و يا کاملاً متفاوت باشند .
انتقال گرماي جا به جايي توسط حركت تصادفي مولكولي و حركت كپه اي سيال در لايه مرزي تداوم مي يابد . حركت تصادفي مولكولي ( پخش ) در نزديكي سطح ، كه در آنجا سرعت سيال كم است ، سهم اصلي را دارد . يعني اينکه در اين ناحيه به علت نبودن سرعت بالا سيال نمي تواند به طور مناسب با سطح تبادل حرارتي انجام دهد از طرفي در فصل مشترك بين سطح و سيال ( y = 0 ) سرعت سيال صفر است و گرما فقط توسط مكانيزم پخش منتقل مي شود يعني ئر اين ناحيه بيشتر رسانش کار انتقال گرما را انجام مي دهد .
جابجايي را مي توان بنا به نحوه انجام فرايند به دو دسته واداشته ( Force Convection) و يا جايجايي آزاد(Natural Convection) تقسيم کرد .
اگر جابجايي توسط وسائل مکانيکي مانند فن , پمپ و يا توربين انجام شود جابجايي را واداشته و اگر اختلاف چگالي سبب اين جابجايي شود آن را آزاد مي نامند .
در برخي مواقع ممکن است ترکيبي از هر دو فراين را با هم داشته باشيم و از هردو فرايند استفاده کنيم يعني نرخ انتقال توسط جابجايي آزاد کم بوده و براي افزايش نرخ انتقال حرارت از جابجايي واداشته استفاده مي شود .
انتقال حرارت توسط سيال متناسب است با دماي سيال و دماي سطح اين دماها در حقيقت دماي موضعي و يا دماي متوسط سطح و سيال است .
اين تناسب توسط ضريب ثابتي به تساوي تبديل مي گردد اين ضريب متناسب با خواص سيال و سرعت سيال بستگي دارد که اين ويژگي ها با هم در عدد رينولدز جمع مي شوند .
معادله آهنگ آن به صورت زير است :
كه در آن ، شار گرماي جابجايي ( W/m2 ) ، با اختلاف دماي Ts سطح و دماي سيال متناسب است . رابطه بالا را قانون سرمايش نيوتن و ثابت تناسب h ( بر حسب W/m2.k ) را ضريب انتقال گرماي جابجايي مي گويند .
تابش ( Radiation )
هر جسم در هر دمايي از خود تابش مي کند و مقداري انرژي را نيز از محيط اطراف جذب مي کند برايند اين جذب و دفع برابر است مقدار انرژي که از سطح خارج و يا به آن وارد مي شود .
اين نوع انتقال گرما نيز متناسب است با توان چهارم دماي سطح و دماي جسم اين تناسب نيز توسط ضريبي به تساوي تبديل مي شود اين ضريب ضريب جذب ناميده مي شود و تابعي از هندسه سطح و نوع و جنس آن است .
شار گرمايي توسط تابش را مي توان با رابطه زير يافت .
با ضرب اين مقدار در مساحت سطح مود نظر مي توان مقدار خالص گرماي مباذله شده را يافت
قانون فوريه :
در تحليل رسانش در يک بعد معروفترين و کاربردي ترين رابطه و قانون قانون فوريه است اختلاف درجه حرارت باعث انتقال حرارت مي شود که مقدار آن را با رابطه فوريه بدست مي آوريم .
آزمايش تحليل رسانايي يک بعدي :
در تحليل رسانش يک بعدي فرض بر اين است که گرما فقط در يک جهت و در جهت فقط يک محور منتقل
مي گردد و از انتقال گرما در ساير راستاها صرف نظر مي شود .
در اين آزمايش با داشتن منبع حرارتي و با استفاده از ترموکوپلهايي که در فواصل معيني از هم قرار گرفته اند
مي توان مسئله رسانش در يک بعد را مورد بررسي قرار داد .
شرح ساختمان دستگاه:
سيستم گرمايش :
براي شبيه سازي منبع گرمايي مي بايست يک مقدار مشخص انرژي به جسم داده شود که اين مقدار را با الکتريسيته تامين مي کنيم. وQ=V.I است.که در هر مرحله ولتاژ و جريان را تغيير مي دهيم و در واقع Q را تغيير داده ايم. در هر مرحله مي توان با استفاده از دستگاه مقدار ولتاژ و جريان متناظر آن را يافت و با ضرب اين دو در هم مقدار گرما را يافت .
سيستم خنک کننده :
از آب شهر براي خنک کردن استفاده مي شود که با يک لوله به سيستم وارد مي شود وپس از خنک کاري سيستم دوباره برمي گردد.
سيستم عايق بندي:
براي جلوگيري از انتقال حرارت جابجاي و تابشي سيستم را در يک پوشش پلاستيکي ضخيم قرار داده ايم که مانع از برخورد هوا به آن مي شود.
وسايل موجود روي دستگاه:
توليد انرژي حرارتي: اين کار توسط يک المنت حرارتي انجام مي شود در حقيقت کار اين المنت تبديا الکتريسته به گرما مي باشد و مقدار گرماي توليد شده نيز متناظر با حاصل ضرب ولتاژ در جريان است.
دماسنج : اين دستگاه شامل تعدادي سنسور است که در قسمت هاي مختلف نصب شده است و دما را در روي صفحه دستگاه نمايش مي دهند.
تئوري اساسي:
در واقع در اين آزمايش ما مي خواهيم مقدار k را در حالتهاي محوري و شعاعي بدست آوريم. براي اين کار ابتدا يک مقدار انرژي به يک ميله رسانا مي دهيم و سپس دما را در قسمت هاي مختلف آن اندازه مي گيريم و با استفاده از رابطه فوريه مقدار k را بدست مي آوريم: مهمترين کار در اين آزمايش يافتن شيب خط تغييرات دما بر حسب تغييرات فاصله است که براي ولتاژهاي مختلف مقادير يکسان به دست مي آيد و از طرفي با داشتن شار گرمايي که همان حاصل ضرب ولتاژ در جريان است مي توان مقدار ثابت را در دو حالت محوري و شعاعي يافت .
با توجه به قانون فوريه مي توان براي سيستم محوري نمودار فاصله بر حسب دما را رسم کرد و براي سيستم شعاعي نيز بنا به روابط زير مي توان از لگاريتم طبيعي استفاده کرد .
نحوه انجام آزمايش :
آزمايش را با ولتاژ اوليه 40v و 80v براي هردو سيستم شعاعي و محوري انجام داده و نتايج را در جدول زير آورده و سپس نمودار دما بر حسب فاصله براي سيستم محوري و دما بر حسب لگاريتم طبيعي فاصله را براي سيستم شعاعي رسم مي کنيم و از آن مقدار ضريب ثابت را مي يابيم .
اين دو نمودار بايد خطي بوده و شيب براي مقادير مختلف ولتاژ بايد برابر باشند يعني براي سيستم محوري نمودارهاي يافته شده بايد موازي باشند و همچنين براي سيستم شعاعي .
براي تحليل سيستم انتقال حرارت يک بعدي سيستم را به گونه نشان داده در نظر مي گيريم.
همانطور که مي بينيم T بر حسب X تقريبا خطي است و دما بر حسب Ln(r) نيز تقريباً خطي است .
بيشترين تغييرات دمايي بين دو ترمومتر شماره 3 و 4 است چون در اين قسمت دو تکه فلز به هم وصل شده و هوا مانند عايقي عمل مي کند و سبب تغييرات دمايي و خارج شدن از حالت خطي مي گردد
شيب خط در اولي تقريباً برابر است با 195 و در شعاعي برابر است با 5.675 با داشتن مقدار Q داريم که
0.0656= 195/12.8 و براي شعاعي نيز برابر است با 2.2555 = 5.675/12.8
با داشتن مقدار طول مي توان مقدار K دردر سيستم شعاعی محاسبه کرد .
منابع خطا :
ولتاژ دستگاه ثابت نمي شد.
دماي دماسنجها ثابت نمي شد و دامنه نوسان آنها خيلي زياد بود.
دو تکه فلز به خوبي به هم متصل نمي شدند و يک مقاومت سطحي بين آنها وجود داشت که باعث خطا مي شد اين خطا بيشتر در نواحي که دو فلز به متصل مي شدند نمود داشت .
منابع و ماخذ :
1-مقدمه اي بر انتقال گرما ، نويسنده فرانک-پ.اين کروپرا و ديويد-پ. دويت ،ويرايش چهارم
2- دستور کار آزمايشگاه انتقال حرارت








 پاسخ با نقل قول
پاسخ با نقل قول





علاقه مندی ها (بوک مارک ها)