جدول تناوبی periodic table
جدول تناوبی
periodic tableشیمی - مقالاتجدول تناوبی عنصرهای شیمیایی، نمایشی از عنصرهای شیمیایی شناخته شدهاست که بر اساس ساختار الکترونی مرتب گردیدهاست بهگونهای که بسیاری از ویژگیهای شیمیایی عنصرها به صورت منظم در طول جدول تغییر میکنند.
جدول اولیه بدون اطلاع از ساختار داخلی اتمها ساخته شد: اگر عناصر را بر حسب جرم اتمی آنها مرتب نماییم، و آنگاه نمودار خواص معین دیگر آنها را بر حسب جرم اتمی رسم نماییم، میتوان نوسان یا تناوب این خواص را بصورت تابعی از جرم اتمی مشاهده نمود. نخستین کسی که توانست این نظم را مشاهده نماید، یک شیمیدان آلمانی به نام یوهان ولفگانگ دوبِرَینر (Johann Wolfgang Döbereiner) بود. او متوجه تعدادی تثلیث از عناصر مشابه شد:
نمونه تثلیثها
عنصر جرم اتمی چگالی
Cl ۳۵.۵ ۱.۵۶ g/L
Br ۷۹.۹ ۳.۱۲ g/L
I ۱۲۶.۹ ۴.۹۵ g/L
Ca ۴۰.۱ ۱.۵۵ g/cm۳
Sr ۸۷.۶ ۲.۶ g/cm۳
Ba ۱۳۷ ۳.۵ g/cm۳
و به دنبال او، شیمیدان انگلیسی جان نیولندز (John Alexander Reina Newlands) متوجه گردید که عناصر از نوع مشابه در فاصلههای هشت تایی یافت میشوند، که آنها را با نتهای هشتگانه موسیقی شبیه نمود، هرچند که قانون نتهای او مورد تمسخر معاصرین او قرار گرفت. سرانجام شیمیدان آلمانی لوتار مَیر (Lothar Meyer) و شیمیدان روسی دمیتری مندلیف (Dmitry Ivanovich Mendeleev) تقریباً بطور همزمان اولین جدول تناوبی را، با مرتب نمودن عناصر بر حسب جرمشان، توسعه دادند(ولی مندلیف تعداد کمی از عناصر را خارج از ترتیب صریح جرمی، برای تطابق بهتر با خواص همسایگانشان رسم نمود – این کار بعدها با کشف ساختار الکترونی عناصر در اواخر سده نوزدهم و آغاز سده بیستم توجیه گردید).
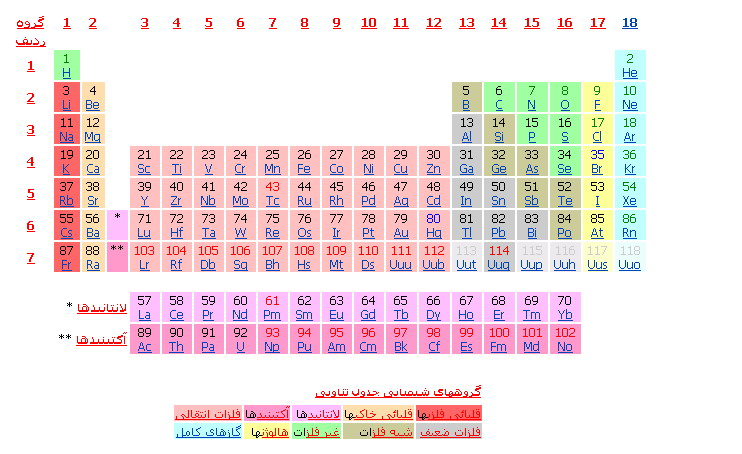
فهرست عناصر بر پایه نام، علامت اختصاری و عدد اتمی موجود است. شکل زیر جدول تناوبی عناصر شناخته شده را نمایش میدهد. هر عنصر با عدد اتمی و علامتهای شیمیایی. عناصر در یک ستون («گروه») از لحاظ شیمیایی مشابه میباشند.
گروه ۱ ۲ ۳ ۴ ۵ ۶ ۷ ۸ ۹ ۱۰ ۱۱ ۱۲ ۱۳ ۱۴ ۱۵ ۱۶ ۱۷ ۱۸
دوره
۱ ۱
H ۲
He
۲ ۳
Li ۴
Be ۵
B ۶
C ۷
N ۸
O ۹
F ۱۰
Ne
۳ ۱۱
Na ۱۲
Mg ۱۳
Al ۱۴
Si ۱۵
P ۱۶
S ۱۷
Cl ۱۸
Ar
۴ ۱۹
K ۲۰
Ca ۲۱
Sc ۲۲
Ti ۲۳
V ۲۴
Cr ۲۵
Mn ۲۶
Fe ۲۷
Co ۲۸
Ni ۲۹
Cu ۳۰
Zn ۳۱
Ga ۳۲
Ge ۳۳
As ۳۴
Se ۳۵
Br ۳۶
Kr
۵ ۳۷
Rb ۳۸
Sr ۳۹
Y ۴۰
Zr ۴۱
Nb ۴۲
Mo ۴۳
Tc ۴۴
Ru ۴۵
Rh ۴۶
Pd ۴۷
Ag ۴۸
Cd ۴۹
In ۵۰
Sn ۵۱
Sb ۵۲
Te ۵۳
I ۵۴
Xe
۶ ۵۵
Cs ۵۶
Ba * ۷۱
Lu ۷۲
Hf ۷۳
Ta ۷۴
W ۷۵
Re ۷۶
Os ۷۷
Ir ۷۸
Pt ۷۹
Au ۸۰
Hg ۸۱
Tl ۸۲
Pb ۸۳
Bi ۸۴
Po ۸۵
At ۸۶
Rn
۷ ۸۷
Fr ۸۸
Ra ** ۱۰۳
Lr ۱۰۴
Rf ۱۰۵
Db ۱۰۶
Sg ۱۰۷
Bh ۱۰۸
Hs ۱۰۹
Mt ۱۱۰
Ds ۱۱۱
Uuu ۱۱۲
Uub ۱۱۳
Uut ۱۱۴
Uuq ۱۱۵
Uup ۱۱۶
Uuh ۱۱۷
Uus ۱۱۸
Uuo
* لانتانیدها ۵۷
La ۵۸
Ce ۵۹
Pr ۶۰
Nd ۶۱
Pm ۶۲
Sm ۶۳
Eu ۶۴
Gd ۶۵
Tb ۶۶
Dy ۶۷
Ho ۶۸
Er ۶۹
Tm ۷۰
Yb
** آکتینیدها ۸۹
Ac ۹۰
Th ۹۱
Pa ۹۲
U ۹۳
Np ۹۴
Pu ۹۵
Am ۹۶
Cm ۹۷
Bk ۹۸
Cf ۹۹
Es ۱۰۰
Fm ۱۰۱
Md ۱۰۲
No
کد رنگ برای اعداد اتمی:
* عناصر شماره گذاری شده با رنگ آبی ، در دمای اتاق مایع هستند؛
* عناصر شماره گذاری شده با رنگ سبز ، در دمای اتاق بصورت گاز میباشند؛
* عناصر شماره گذاری شده با رنگ سیاه، در دمای اتاق جامد هستند.
* عناصر شماره گذاری شده با رنگ قرمز ترکیبی بوده و بطور طبیعی یافت نمیشوند(همه در دمای اتاق جامد هستند.)
* عناصر شماره گذاری شده با رنگ خاکستری ، هنوز کشف نشدهاند (و بصورت کم رنگ نشان داده شدهاند تا گروه شیمیایی را که در آن قرار میگیرند، مشخص نماید.(
و میتوانید دراین کلید واژه جدول تناوبی برای تشدید مغناطیسی را بیابید.
تعداد لایه الکترون در یک اتم تعیین کننده ردیفی است که در آن قرار میگیرد. هر لایه به زیرلایههای متفاوتی تقسیم میشود، که هر اندازه عدد اتمی افزایش مییابد، این لایهها به ترتیب زیر:
۱s…
۲s ۲p
۳s ۳p
۴s ۳d ۴p
۵s ۴d ۵p
۶s ۴f ۵d ۶p
۷s ۵f ۶d ۷p
۸s ۵g ۶f ۷d ۸p
براساس ساختار جدول پر میشوند. از آنجاییکه الکترونهای خارجیترین لایه، خواص شیمیایی را تعیین مینمایند، این لایهها در میان گروهای یکسان مشابهاند.عناصر همجوار با یکدیگر در یک گروه، علیرغم اختلاف مهم در جرم، دارای خواص فیزیکی مشابه هستند. عناصر همجوار با یکدیگر در یک ردیف دارای جرمهای مشابه ولی خواص متفاوت هستند.
برای مثال، عناصر بسیار نزدیک به نیتروژن (N) در ردیف دوم کربن(C) و اکسیژن(O) هستند. علیرغم تشابه آنها در جرم (که بصورت ناچیزی در واحد جرم اتمی تفاوت دارند)، دارای خواص بینهایت متفاوتی هستند، همانطور که با بررسی فرمهای دیگر میتوان ملاحظه نمود: اکسیژن دو اتمی یک کاز است که سوختن را تشدید مینماید، نیتروژن دو اتمی یک گاز است که سوختن را تشدید نمیکند، و کربن یک جامد است که میتواند سوزانده شود(بله، میتوان الماس را سوزاند!).
در مقایسه، عناصر بسیار نزدیک به کلر (Cl) در گروه یکی مانده به آخر در جدول (هالوژنها) فلویور(F) و برم(Br) هستند. علیرغم تفاوت فاحش جرم آنها در گروه، فرمهای دیگر آنها دارای خواص بسیار مشابه هستند: آنها بسیار خورنده (بدین معنی که تمایل خوبی برای ترکیب با فلزات، برای تشکیل نمک هالاید فلز)؛ کلر و فلویور گاز هستند، درحالیکه برم یک مایع با تبخیر بسیار کم است؛ کلر و برم بسیار رنگی هستند.
دید کلی
عناصر شیمیایی ، بر اساس خصوصیات شیمیایی و فیزیکی ، در گروههای مختلفی در جدول تناوبی طبقهبندی شدهاند. در بین عناصر هر گروه نیز علاوه بر برخی تشابهات ، تفاوتهای عمدهای نیز وجود دارد.عناصر را با مشخصات گوناگونی طبقهبندی میکنند. یکی از آن مشخصات ، آرایش الکترونی میباشد. عناصر را میتوان بر اساس آرایش الکترونی آنها به چهار گروه تقسیم کرد.
گازهای نجیب
در جدول تناوبی ، گازهای نجیب در انتهای هر دوره جای دارند. این عناصر گازهای بیرنگ ، از نظر شیمیایی غیر فعال و دیا مغناطیسی هستند. به استثنای هلیم ، تمام گازهای نجیب دارای آرایش الکترونی خارجی ns۲ np۶ هستند که آرایشهای بسیار پایدارند.
عناصر نماینده
این عناصر ، گروه های A از جدول تناوبی را تشکیل میدهند و شامل فلزات و غیر فلزات هستند. خواص شیمیایی و فیزیکی این عناصر بسیار متنوع است. بعضی از آنها دیامغناطیس و بعضی دیگر پارامغناطیس هستند. ولی ترکیبات این عناصر معمولا دیامغناطیس و بیرنگ هستند. لایه های الکترونی تمام این عناصر یا کامل هستند و یا پایدارند به استثنای لایههای خارجی که الکترونهای آنها را میتوان بعنوان الکترونهای اضافه شده در نظر گرفت.
این لایه خارجی را لایه والانس و الکترونهای آن را الکترونهای والانس مینامند. تعداد الکترونهای والانس هر اتم برابر شماره گروه آن اتم است. خواص شیمیایی این عناصر ، به تعداد الکترونهای والانس آنها بستگی دارد.
عناصر واسطه
عناصر واسطه ، گروههای B از جدول تناوبی را تشکیل میدهند. از ویژگیهای این عناصر ، درون سازی آنهاست. یعنی آخرین الکترونی که بر اساس روش آفبا به آنها اضافه میشود، یک الکترون d درونی است. الکترونهای دو لایه آخری عناصر واسطه در واکنشهای شیمیایی مورد استفاده قرار میگیرند. تمام این عناصر ، فلز بوده، بیشتر آنها پارامغناطیسیاند و ترکیبات شدیدا رنگین و پارامغناطیس تولید میکنند.
عناصر واسطه داخلی
این عناصر در پایین ، جدول تناوبی قرار دارند. یک سری از عناصر دوره ششم که بعد از لانتانیم قرار دارند، سری لانتانیدها نامیده میشود و نظیر این سری در دوره هفتم به سری آکتنیدها معروفند. آخرین الکترون اضافه شده به هر یک از این عناصر یک الکترون f است. چون این الکترون به سومین لایه از آخر اضافه میشود، بدین جهت ، سه لایه آخر این عناصر ممکن است در واکنشهای شیمیایی آنها دخالت کنند. تمام عناصر واسطه داخلی فلزند. این عناصر بطور کلی پارامغناطیساند و ترکیبات آنها پارامغناطیس و بشدت رنگین هستند.









 پاسخ با نقل قول
پاسخ با نقل قول




علاقه مندی ها (بوک مارک ها)